Fetuin-A/alpha-2-Heremans Schmid-glycoprotein (FETUA/AHSG), Fetuin-B (FETUB), Histidine-reiches Glycoprotein (HRG) and Kininogen (KNG) sind Mitglieder der Cystatin-Superfamilie, einer Untergruppe der Cystein-Proteinaseinhibitoren. Sie bilden die so genannten Typ 3 Mitglieder, die alle in der Leber synthetisiert und ins Blut sezerniert werden. Alle Typ 3 Cystatine haben mehrere Disulfid-Brücken. Jedes Protein ist von einem einzigen Gen codiert. Die Gene liegen in unmittelbarer Nachbarschaft in allen bekannten Vertebraten-Genomen und sind eng verwandt. Abbildung 1 zeigt schematisch die Proteinstruktur der Typ 3-Cystatine.
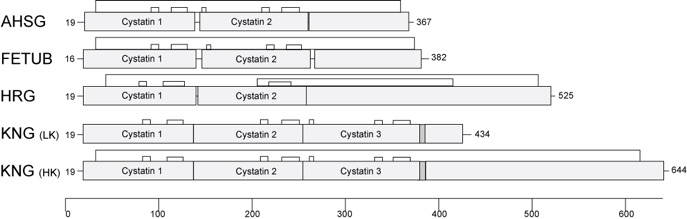
Abbildung 1 Schematische Darstellung der Typ 3 Cystatine. Fetuin-A (AHSG/FETUA), fetuin-B (FETUB), histidine-rich glycoprotein (HRG) und Kininogen (KNG), das als low molecular weight kininogen (LK) und als high molecular weight kininogen (HK) vorkommt, gehören alle zum Typ 3 innerhalb der Cystatin-Superfamilie. Die Proteine haben zwei oder drei aminoterminale Cystatin-Domäne, die durch Disulfidbrücken stablisiert sind. Die Nummerierung der Aminosäuresequenz beginnt nach den Signalpeptiden, die bei der Sekretion abgespalten werden, und gibt die Gesamtzahl der Aminosäuren im zirkulierenden Protein des Menschen an.
Die Fetuin-Gene entstanden durch Duplikation von Cystatin-Proteindomänen und Fusion mit weiteren stabilen Geneinheiten. Die Kombination von stabilen und in der Evolution konservierten Protein-Bausteinen brachte Proteine hervor, die zwar ganz ähnlich aufgebaut sind, aber vollkommen verschiedene Funktionen haben. Das läßt sich am besten am Beispiel der Proteine Fetuin-A und Fetuin-B erklären. Beide Proteine haben drei Domänen, sind ähnlich gross, werden hauptsächlich in der Leber gemacht und werden ins Blut sezerniert. Durch genetische Untersuchungen an Mausstämmen, denen gezielt die jeweiligen Gene entfernt wurden, durch sog. knockout-Mäuse fanden wir heraus, dass Fetuin-A hauptsächlich dafür verantwortlich ist, den Transport und die Stabilität von Mineral im Körper zu bewerkstelligen, wohingegen Fetuin-B hochspezifisch sog. Zink-Metalloproteinasen hemmt. Die Knockout-Mäuse zeigen trotz der engen Verwandschaft der Proteine daher frappierend unterschiedliche Phänotypen, d. h. der Mangel an Fetuin-A und Fetuin-B hat völlig unterschiedliche Konsequenzen. Fetuin-A knockout-Mäuse zeigen im ganzen Körper Kalkablagerungen, die mit zunehmendem Alter zu Einschränkungen der Organfunktionen führen, während Fetuin-B knockout-Mäuse als Weibchen komplett infertil sind, weil die Hülle der Eizellen dieser Weibchen bereits vor der Befruchtung verhärten und dadurch die Befruchung verhindern.
Neben diesen klar nachweisbaren Funktionen haben beide Proteine vermutlich noch andere, nachgeordnete Funktionen, die anderen Orts in den Vordergrund gestellt werden, sich aber in den Knockout-Mäusen nicht nachweisen lassen. Das heisst nicht, dass derlei Funktionen nicht im Experiment beobachtet werden können, nur sind sie im Gegensatz zu den gerade geschilderten Funktionen nicht durchgehend durch genetische, biochemische, molekularbiologische und klinische Studien belegbar, sondern häufig nur durch Einzelbeobachtung an ausgewählten experimentellen Systemen.
Einführungen in die Funktion und Wirkweise der Fetuin-Proteine finden sich in den nachfolgend aufgeführten Übersichtsartikeln und der darin zitierten Literatur, sowie in der Literaturliste, die sich beim Anklicken des Menüpunkts "Publikationen" öffnet. Weitere Details unter "Biomineralisation" und "Reproduktionsbiologie" auf der Startseite. Viel Spaß beim Lesen!
Übersichtsartikel
Type 3 cystatins; fetuins, kininogen and histidine-rich glycoprotein.
Lee C, Bongcam-Rudloff E, Sollner C, Jahnen-Dechent W, Claesson-Welsh L.
Front Biosci (Landmark Ed). 2009 Jan 1;14:2911-22. Review.
PMID: 19273244
Nature's remedy to phosphate woes: calciprotein particles regulate systemic mineral metabolism.
Jahnen-Dechent W, Smith ER.
Kidney Int. 2020 Apr;97(4):648-651. doi: 10.1016/j.kint.2019.12.018. PMID: 32200857
Fetuin-A regulation of calcified matrix metabolism.
Jahnen-Dechent W, Heiss A, Schäfer C, Ketteler M.
Circ Res. 2011 Jun 10;108(12):1494-509. doi: 10.1161/CIRCRESAHA.110.234260. Review. PMID: 21659653
Structure of mammalian plasma fetuin-B and its mechanism of selective metallopeptidase inhibition.
Cuppari A, Körschgen H, Fahrenkamp D, Schmitz C, Guevara T, Karmilin K, Kuske M, Olf M, Dietzel E, Yiallouros I, de Sanctis D, Goulas T, Weiskirchen R, Jahnen-Dechent W, Floehr J, Stoecker W, Jovine L, Gomis-Rüth.
FX.IUCrJ. 2019 Feb 28;6(Pt 2):317-330. doi: 10.1107/S2052252519001568. eCollection 2019 Mar 1. PMID: 30867929
Fetuin-B, a liver-derived plasma protein is essential for fertilization.
Dietzel E, Wessling J, Floehr J, Schäfer C, Ensslen S, Denecke B, Rösing B, Neulen J, Veitinger T, Spehr M, Tropartz T, Tolba R, Renné T, Egert A, Schorle H, Gottenbusch Y, Hildebrand A, Yiallouros I, Stöcker W, Weiskirchen R, Jahnen-Dechent W.
Dev Cell. 2013 Apr 15;25(1):106-12. doi: 10.1016/j.devcel.2013.03.001. Epub 2013 Apr 4. PMID: 23562279



